Аккумуляторы, изменившие жизнь
Нобелевская премия по химии 2019 года присуждена Джону Гуденафу (John Goodenough), Майклу Стэнли Уиттингему (M. Stanley Whittingham) и Акире Ёсино (Akira Yoshino) «за разработку литий-ионных аккумуляторов». Как указал Нобелевский комитет, «своей работой они создали условия для беспроводного общества, свободного от ископаемого топлива, и тем самым принесли человечеству огромную пользу».



История химических источников тока насчитывает более двухсот лет. Нобелевские премии присуждают уже 119 лет, но только в этом, 2019 году Нобелевская премия по химии была присуждена за создание литий-ионных аккумуляторов. Литий-ионные аккумуляторы в настоящее время — наиболее популярные перезаряжаемые источники энергии благодаря своим уникальным характеристикам: высокой удельной энергии, то есть способности работать долгое время без подзарядки, длительному сроку службы, достигающему 2000 циклов заряда-разряда, и высокому напряжению, превышающему почти в два раза напряжение, например, свинцово-кислотных аккумуляторов. Первоначально литий-ионные аккумуляторы были предназначены исключительно для питания портативных приборов, но в последнее время рассматривается вопрос об их применении в различных видах транспорта и стационарных накопителях энергии.
Созданию литий-ионных аккумуляторов предшествовало изобретение литиевых аккумуляторов — электрохимических систем с металлическим литиевым отрицательным электродом. Ясно, что в таких устройствах нельзя было использовать водные электролиты. Литий — активный щелочной металл, который при взаимодействии с водой или водным электролитом бурно реагирует с образованием гидроксида лития и водорода. Эта реакция необратимая, то есть идёт только в одну сторону, а для работы аккумулятора необходимо многократное протекание реакции на электродах в прямом и обратном направлениях. Электролит литиевого аккумулятора представляет собой раствор соли лития в органическом растворителе. При контакте органического растворителя с металлическим литием на поверхности последнего образуется особый защитный слой, так называемая пассивная плёнка, которая обеспечивает в дальнейшем многократное протекание реакции растворения и осаждения лития. Наиболее известные примеры таких аккумуляторов — системы «литий — дисульфид титана» или «литий — дисульфид молибдена». В таких аккумуляторах положительным электродом служит дисульфид титана или дисульфид молибдена.
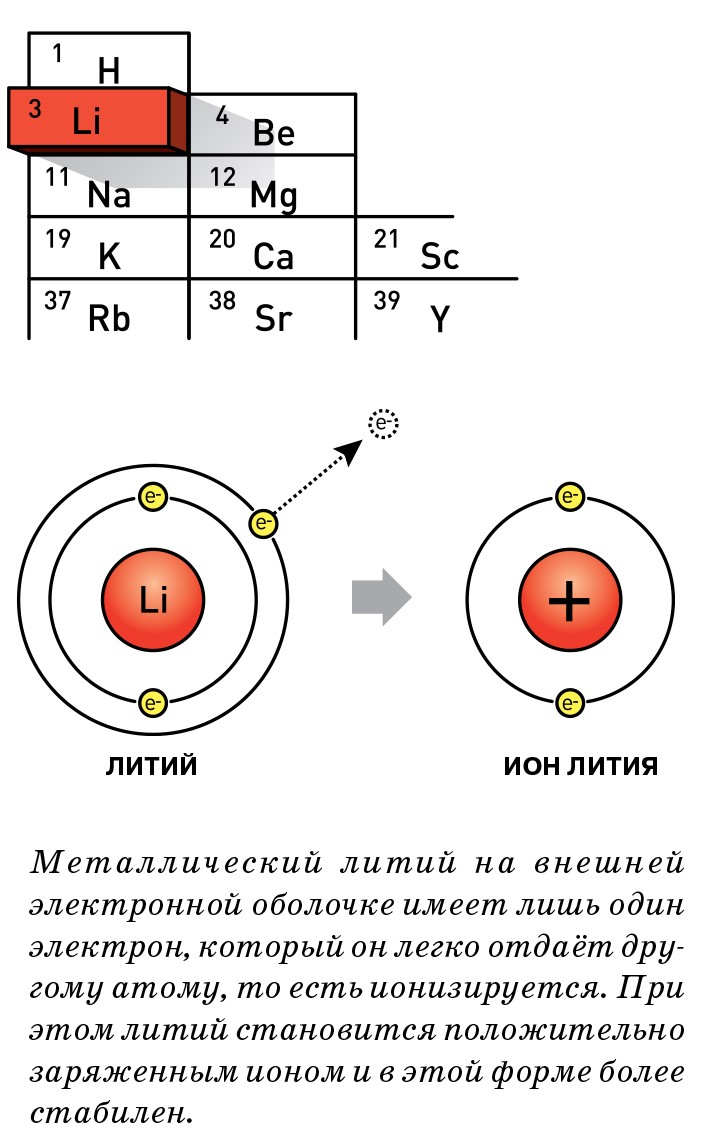
Именно эти материалы синтезировал один из лауреатов Нобелевской премии по химии 2019 года — Майкл Уиттингем. Ещё в 1970 году он обнаружил, что матрица дисульфида титана или дисульфида молибдена способна обратимо интеркалировать (включать в себя) ионы лития, которые встраивались в кристаллическую решётку при разряде аккумулятора и экстрагировались из неё при заряде. Таким образом, была показана принципиальная возможность синтеза материалов, способных обратимо интеркалировать ионы лития. Напряжение такого аккумулятора было невелико (около 2,3 В), но всё же выше, чем напряжение источников тока с водными электролитами. Основная проблема для такой системы заключалась в работе отрицательного электрода — металлического лития. При заряде подобного аккумулятора на отрицательном электроде протекает процесс осаждения лития и последний, как правило, осаждается в виде так называемых дендритов — металлических усов, которые, достигая длины нескольких микрон, способны проколоть сепаратор, разделяющий электроды, и привести к короткому замыканию между катодом и анодом. Короткое замыкание, в свою очередь, вызовет разогрев, воспламенение и взрыв аккумулятора. Именно по этой причине такие литиевые аккумуляторы не получили широкого развития.
В 1980 году профессор Джон Гуденаф с сотрудниками синтезировал литированный оксид кобальта (LiCoO2) и показал возможность обратимой электрохимической экстракции ионов лития, что было принципиально для создания литий-ионных аккумуляторов. Кристаллическая решётка синтезированного материала содержала ионы лития, находящиеся между слоями CoO6. Такая слоистая структура позволяла извлекать ионы лития из LiCoO2 при наложении анодного тока и внедрять их обратно при катодной нагрузке. Первые эксперименты по обратимой экстракции лития из LiCoO2 были проведены в паре с металлическим литием (противоэлектродом); по сути, это был литиевый аккумулятор, аналогичный ранее предложенному Майклом Уиттингемом, но с другим положительным электродом.
Преимущество литированного оксида кобальта по сравнению, например, с дисульфидом титана заключалось в том, что обратимый процесс внедрения-экстракции лития протекал при потенциалах около 4 В, что более чем на 1,5 В выше потенциала процесса обратимого внедрения — экстракции лития в дисульфид титана или дисульфид молибдена. Из школьной программы известно, что напряжение источника тока равно разности между потенциалами катода и анода, поэтому очевидно, что использование LiCoO2 в качестве катода даёт увеличение напряжения источника тока. Однако в электрохимической системе с металлическим литием это ещё больше повышало вероятность воспламенения аккумулятора в случае короткого замыкания из-за роста дендритов на литии. Именно поэтому электрохимики пытались найти другой материал для отрицательного электрода, который был бы способен обратимо аккумулировать литий при достаточно низких потенциалах.
