Двойная жизнь АТФ: и «батарейка», и нейромедиатор

Посвящаю статью памяти Джеффри Бёрнстока (1929—2020), человека, который открыл вторую «профессию» аденозинтрифосфата.
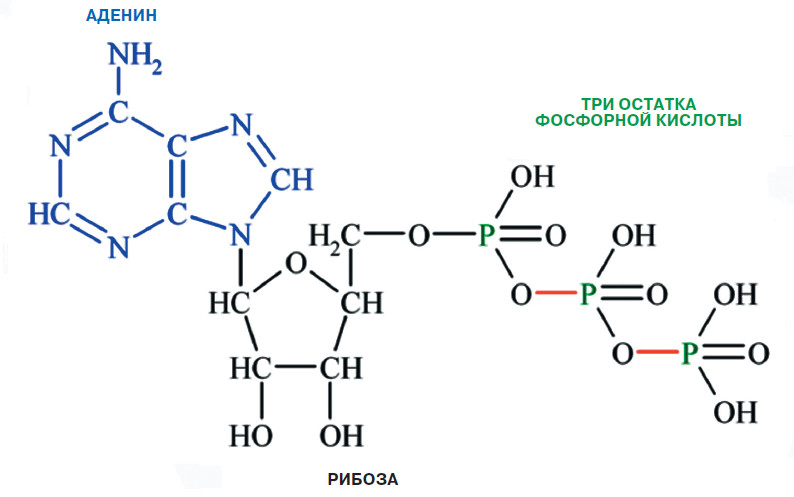
Об аденозинтрифосфорной кислоте, или аденозинтрифосфате (АТФ), одной из самых важных молекул в нашем организме, наверное, слышали все. Чаще всего АТФ рассматривается как универсальное топливо для многочисленных «молекулярных машин» и реакций в наших клетках. Без него сама жизнь в том виде, в котором она есть сейчас, была бы невозможна. Но вне клетки у АТФ есть и другая роль — способствовать передаче нервных импульсов. Каким же образом клеточное «топливо» становится нейромедиатором?
Изначально источником АТФ служил лишь процесс гликолиза — бескислородного окисления глюкозы в цитоплазме. Такой способ оказался неэффективным и мог снабжать энергией лишь доядерные организмы — прокариоты. Появление в клетках верных вассалов — митохондрий позволило вывести производство АТФ на качественно новый уровень и получать его в недостижимых ранее количествах. В митохондриях это происходит при помощи цикла Кребса. Благодаря окислительному фосфорилированию, протекающему в этих органеллах, и клеточному дыханию возникло всё многоклеточное биоразнообразие. АТФ в клетках стало много. За сутки общее количество расходуемого и вновь синтезируемого этого вещества в нашем теле исчисляется килограммами.
Более удивительным оказалось то, что и молекула АТФ, и «топливные отходы», получающиеся в результате разрыва фосфатных связей, — часть обширного сигнального аппарата. Эта древняя система сигнализации охватывает весь организм и запускает сложные клеточные процессы. Она сообщает нам, когда идти спать, и она же заставляет нас кричать от боли. Находясь на службе клеточного иммунитета, она может как спасти организм от инфекции, так и привести к гибели клеток, став причиной множества воспалительных заболеваний. Более того, АТФ напрямую участвует в регуляции нашей нервной деятельности и служит эффективным нейромедиатором. Однако далеко не сразу эта функция стала очевидной. Чтобы её обнаружить, потребовались годы усердной работы и исключительное упрямство одного исследователя.
Открытие Бёрнстока, в которое не хотели верить
В начале 1960-х годов британский нейробиолог Джеффри Бёрнсток совершил открытие. Пребывая в Австралии, он исследовал возбуждение гладкой мускулатуры кишечника морской свинки при помощи электрического тока. В то время появились новые электрохимические методы и учёному не терпелось их опробовать на практике. Ему хотелось проверить, как гладкая мускулатура будет реагировать на ток в условиях полной блокировки всех известных нервных рецепторов в данном срезе ткани. Нейробиологи лишние рецепторы обычно блокируют нейротоксинами, которыми нас снабдила сама эволюция в лице ядовитых растений и животных (ну, и заодно химиков-синтетиков), и потом изучают те, что остались рабочими. Бёрнсток обработал ткань синтетическим нейротоксином 6-гидроксидофамином и накачал её атропином.
Далее он ввёл электрод и простимулировал ткань коротким электрическим импульсом. Ожидалось, что гладкая мускулатура неотвратимо сократится, однако ничего подобного не произошло. Какая-то неведомая сила противодействовала импульсам тока и запускала процессы, мешающие сокращению. На записях электрических сигналов наблюдалась выраженная гиперполяризация, а мышцы расслаблялись даже при серии таких импульсов.
На счастье, в тот момент Бёрнсток работал с аспирантом из Японии, который использовал свои связи на родине и достал для исследователя тетродотоксин из рыбы фугу. Этот токсин известен тем, что может блокировать нервную проводимость и, как пробка, затыкать натриевые каналы. Однако он не лишает гладкую мускулатуру способности сокращаться (см. статью моего однокурсника Антона Кротова «Тетродотоксин: история превращения яда в лекарство», «Наука и жизнь» № 7, 2017 г.). Смертоносное вещество было также принято Бёрнстоком в работу.
После его применения реакция на электрический разряд наконец стала такой, какой ожидалась — гиперполяризация пропала, а мышцы сократились. Вывод был очевиден: в нервах гладкой мускулатуры кишечника присутствовали неизвестные рецепторы, которые противодействовали сокращению и тормозили нервный импульс. Начался усиленный поиск вещества, которое могло бы служить активатором этих новых загадочных рецепторов.
Искомый нейромедиатор должен был удовлетворять ряду стандартных критериев. Испробованные нейропептиды, моноамины и аминокислоты не удовлетворяли им. Как это часто бывает, подсказки лежали под ногами. Дело в том, что задолго до работы Джеффри Бёрнстока множество исследователей уже натыкались на странное воздействие внеклеточных пуринов на сердечную мышцу и кровеносные сосуды, но не придали этому большого значения. Например, нобелевский лауреат, американский биохимик венгерского происхождения Альберт Сент-Дьёрдьи — тот самый, что впервые выделил витамин С (практически одновременно с Чарльзом Кингом), — также провёл фундаментальные исследования мышечного сокращения. В своей работе 1929 года Сент-Дьёрдьи отметил, что введение пуриновых соединений в кровь животным влияло на их сердечный ритм. Позже, в 1959 году, Памела Холтон (Великобритания) замечала, что АТФ выделяется при стимуляции нервов в ушных артериях кролика и ведёт к расслаблению стенок сосудов. Однако ни один, ни другая не пошли в своих рассуждениях дальше и не узнали, насколько глубока «кроличья нора».
Вооружившись этими знаниями и проведя ряд опытов, Бёрнсток со своим коллегой Дэвидом Сэтчеллом доказали, что АТФ действительно активирует как стимулирующие, так и тормозящие эффекты в разных типах тканей организма. Свои результаты учёные опубликовали в 1970 году в «British Journal of Pharmacology». Тогда уже стало известно о внеклеточных ферментах, способных расщеплять АТФ. Поэтому Бёрнсток выбрал АТФ на роль нейромедиатора для открытых им рецепторов и выдвинул гипотезу о пуринергической передаче сигнала. Слово «пуринергическая» придумал сам Бёрнсток. Рецепторы, связанные с этим типом передачи сигнала, позже стали называть пуринергическими, или пуринорецепторами.
Вернувшись в Англию, учёный столкнулся с недоверием со стороны коллег. В то время был популярен так называемый принцип Дейла. В нём утверждалось, что один нейрон может осуществлять передачу сигнала при помощи только одного нейротрансмиттера (например ацетилхолина) и уж никак не при помощи нескольких разных. К слову, сам Генри Дейл, английский физиолог, лауреат Нобелевской премии, имел в виду немного другое, но кто его слушал? Всем казалось маловероятным, что вездесущая молекула, источник энергии клеток, может участвовать в тонких процессах регуляции нервной деятельности.
В 1972 году Бёрнсток опубликовал в журнале «Pharmacological Reviews» большую обзорную статью с гипотезой о пуринергических нейротрансмиттерах и их возможной совместной трансмиссии с другими рецепторами нейронов. Эта статья вызвала большой резонанс и стала причиной множества дебатов. В ней Джеффри Бёрнсток сетовал, что результаты его работ списывают на артефакты и ошибки эксперимента ввиду недостаточного научного авторитета его самого. Гипотеза Джеффри продолжала встречать сопротивление в научных кругах на протяжении почти двух десятков лет. Некоторые оппоненты заявляли, что по-святят жизнь разрушению пуринергической теории. Но исследователь не сдавался и упрямо продолжал работу. Следующим шагом предстояло выяснить, что же собой представляют рецепторы, которые могут активироваться сигнальными молекулами АТФ либо продуктами его распада (АТФ → аденозиндифосфат → аденозинмонофосфат → аденозин → аденин).
В те времена выделить и определить структуру этих рецепторов не представлялось возможным. Оставалось действовать на ощупь, то есть скрупулёзно копить данные и логически их сопоставлять. В 1978 году Бёрнстоку удалось выяснить опытным путём, что пуринергические рецепторы можно разделить на два семейства*, которые он назвал P1 и P2 (P — означает пуриновые).
* Говоря о «семействе рецепторов», подразумевают, что раньше (в эволюционно древние времена) эти рецепторы кодировались одним геном, но в результате генетической дупликации возникли его видоизменённые копии, благодаря которым появилось разнообразие родственных рецепторов. Такие белки обычно объединяются в одно семей-ство и сохраняют высокое сходство последовательности и структурной укладки, но могут выполнять разные функции. Это разнообразие особенно велико, если ген белка — ключевой в выживании и эволюции вида при естественном отборе. Например, яды актиний, змей и пауков накопили целые комбинаторные библиотеки из многочисленных видоизменённых копий одного гена какого-нибудь пептидного токсина. Произошло это в результате эволюционного поиска и адаптации яда к своим жертвам, устойчивость которых тоже не стояла на месте в процессе эволюции. Разнообразие же родственных пуринорецепторов для млекопитающих обусловливается усложнением организма и нервной системы в целом.
Это деление на семейства было условным и сделано исключительно по фармакологическим показателям. Рецепторы семей-ства P1 блокировались метилксантинами и активировались аденозином, в то время как члены семейства P2 в основном реагировали на АТФ, а метилксантины были над ними не властны. В 1985 году Бёрнсток установил, что P2-рецепторы можно поделить на два подсемейства — P2X и P2Y. Было это сделано, опять же, основываясь на их фармакологии и разной чувствительности к АТФ и его метиленовым производным.
Развитие методик молекулярного клонирования в начале 1990-х годов, наконец, приоткрыло завесу тайны над загадочными пуринорецепторами. Вначале были клонированы и охарактеризованы рецепторы P1, а потом дошла очередь и до P2. Бёрнстоку окончательно поверили. Исследователи со всего мира бросились изучать новые рецепторы, и количество публикаций на тему «пуринергическая передача сигнала» начало расти буквально в геометрической прогрессии.
