Вести из институтов, лабораторий и экспедиций
Лауреаты премии Правительства Москвы молодым учёным 2019 года
Премия Правительства Москвы молодым учёным, работающим в научных центрах и университетах столицы, вручается уже в седьмой раз. Лауреатами конкурса становятся исследователи моложе 36 лет (для докторов наук граница 40 лет). Сейчас премия присуждается в 22 номинациях, включая достижения в фундаментальных и прикладных исследованиях в области естественных и гуманитарных наук, а также за разработку и внедрение новых технологий. Лауреаты в каждой номинации получают по 2 миллиона рублей; если премия присуждается научному коллективу, тогда сумма делится поровну между исследователями. В феврале 2020 года состоялось вручение премий за 2019 год, а с 20 апреля по 10 июля 2020 года открыт приём новых заявок на участие в конкурсе за 2020 год (подробности: https://nauka.mos.ru).
В прошлом номере журнал рассказывал о работе двух лауреатов 2019 года, Сергея Ильина и Антона Лядова из Института нефтехимического синтеза им. А. В. Топчиева РАН, создавших низкотемпературную биоразлагаемую смазку на основе целлюлозы и её производных (см. «Наука и жизнь» № 5, 2019 г.). Представляем работы ещё нескольких лауреатов конкурса.
Быстро и в каплях: технология поиска новых биопрепаратов
Борьба с коронавирусной инфекцией приковала к себе внимание всего земного шара, но это совсем не повод забыть о других патогенах, которые могут представлять опасность для человечества. Микроорганизмы, а это и вирусы, и бактерии, и грибы, и некоторые другие формы жизни — вся эта мелкая братия, что называется, не дремлет и, как любое живое существо, эволюционирует, приспосабливаясь к меняющимся условиям окружающей среды. Один из таких факторов изменчивости — сам человек, точнее его борьба против микробов. Чтобы не умирать от инфекций, вызванных бактериями, или не умереть от голода, если инфекции поразят сельскохозяйственные культуры или животных, мы широко используем антибиотики. Ответом на это стало возникновение и распространение бактерий, устойчивых к традиционным антибиотикам. К тому же разные микроорганизмы могут передавать друг другу устойчивость к антибиотикам благодаря такому эффекту, как горизонтальный перенос генов. В результате меньше чем за век с начала широкого использования антибактериальных препаратов мы столкнулись с новой проблемой, грозящей поставить жирную точку золотому веку антибиотиков — антибиотикорезистентностью, или, что то же самое, устойчивостью к антибиотикам (см. «Назад в доантибиотиковую эру?», «Наука и жизнь» № 5, 2019 г.).
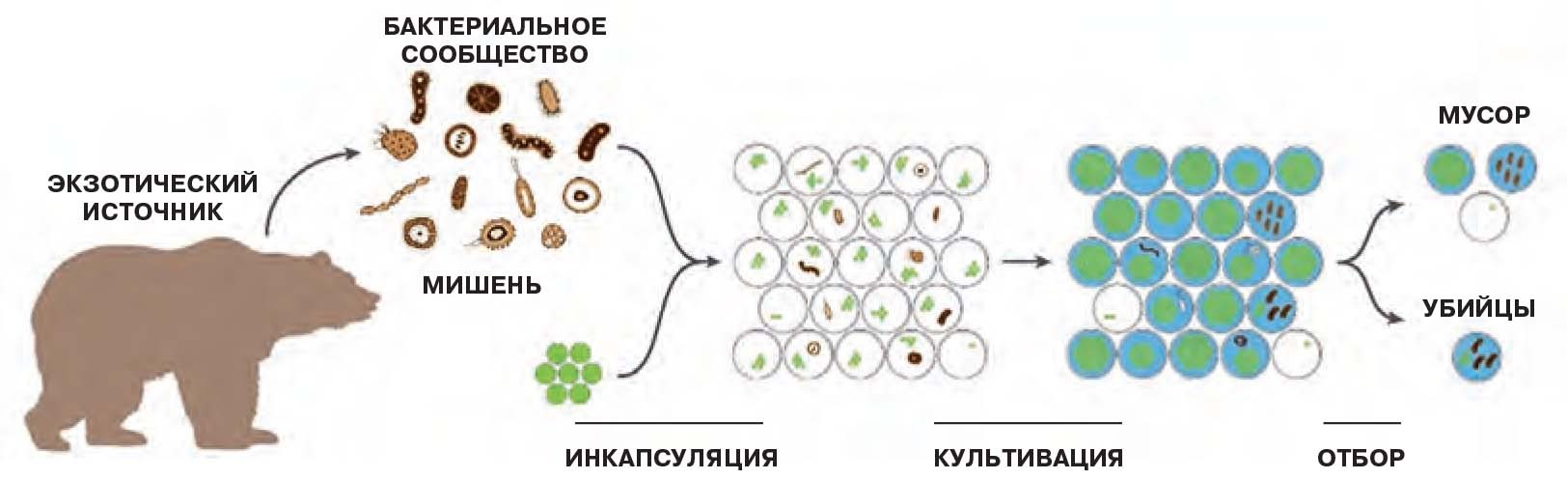
производительного скрининга: 1) отбор проб, содержащих бактериальное сообщество; 2) ин-
капсуляция в каплях эмульсии индивидуальных клеток вместе с клетками-мишенями; 3) рост
колоний бактерий в изолированных каплях; 4) отбор с помощью микрофлюидной технологии
капель с колониями, в которых «дикие» бактерии подавили рост бактерий-мишеней. Именно
в них находятся интересующие исследователей бактерии-«убийцы» со способностью продуцировать антибиотики.
В самой антибиотикорезистентности нет ничего нового — большинство антибиотиков представляют собой природное «оружие», которое разные микроорганизмы используют против бактерий (например, грибы против бактерий, бактерии против других бактерий и т. д.). Соответственно у тех же бактерий существуют эволюционно выработанные механизмы химического нападения и защиты. Проблема заключается в том, что человек, если так можно выразиться, ввязался в «чужую» войну, взяв химические вещества, вырабатываемые одними микроорганизмами, чтобы использовать их против других, опасных для себя возбудителей болезней. Разумеется, те вторые ответили ускоренной эволюцией методов защиты и их передачей своим «братьям по оружию».
Одержать окончательную победу в этой эволюционной гонке не получится, но неплохо попытаться быть на шаг или хотя бы на полшага впереди и иметь в кармане новый антибиотик, когда старый уже утратит свою силу. Для этого нужно уметь находить новые средства борьбы быстрее, чем бактерии успевают к ним адаптироваться. Большинство современных антибиотиков обязаны своим появлением простому и эффективному методу, получившему название «платформа Ваксмана» (по имени первооткрывателя стрептомицина Зельмана Ваксмана). Его суть в том, что на слой питательной среды высевались бактерии из почвы, а затем поверх первого слоя заливался второй, в который уже высевали бактерии-мишени. Если в слое, где росли колонии бактерий-мишеней образовывалась зона просветления, то есть бактерии росли плохо или вовсе погибали, это означало, что какая-то бактерия из нижнего питательного слоя вырабатывала вещество-антибиотик, отравляя жизнь «соседям» сверху. Дальше задача состоит в том, чтобы выделить полезную бактерию и определить действующее вещество. Однако с помощью такого метода можно находить только хорошо культивируемые бактерии, к тому же вырабатывающие антибиотики в больших количествах. Собственно, их довольно быстро и нашли, а вот дальше так искать стало сложнее.
Помочь в поиске новых антибиотиков могут методы высокопроизводительного скрининга, позволяющие в автоматическом режиме исследовать миллионы различных вариантов взаимодействия в биохимических системах. За разработку микрофлюидных технологий и методов синтетической биологии для ультравысокопроизводительного скрининга на уровне единичных живых клеток, которая может быть использована в том числе для поиска новых антибиотиков, двое исследователей, доктор химических наук Илья Андреевич Остерман и кандидат химических наук Станислав Сергеевич Терехов, получили в феврале 2020 года премию Правительства Москвы молодым учёным за 2019 год. Илья Остерман — выпускник химфака МГУ им. М. В. Ломоносова, в настоящее время совмещает должности главного научного сотрудника Центра наук о жизни Сколтеха и старшего научного сотрудника на кафедре химии природных соединений химического факультета МГУ. Станислав Терехов — научный сотрудник Лаборатории биоинформационных методов комбинаторной химии и биологии Института биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова. Так как же устроена эта технология и какие результаты с её помощью можно получить?
Основа метода — помещение индивидуальной живой клетки, например, бактерии, в каплю жидкости, которая становится для неё своеобразным домом, говоря по-современному — клетку принуждают к «самоизоляции». Сама же капля не висит в воздухе и не лежит на поверхности, а находится в другой жидкости — вместе они образуют микрофлюидную эмульсию. Система подобна той, что образуется, если встряхнуть смесь масла и воды: в одной жидкости начинают плавать капли другой. В зависимости от условий можно получать эмульсии с очень малым размером таких капель. Чтобы клетка «не скучала» на самоизоляции, в её каплю-дом можно подселить соседа — бактерию-мишень. Тогда, если первая бактерия умеет делать антибиотики, действующие против бактерий-мишеней, то в таких каплях бактерии-мишени не будут размножаться. Подсмотреть за тем, что происходит в каждой отдельной капле, можно с помощью флуоресцентных маркеров — белков, которые светятся при облучении лазером с определённой длиной волны. Например, если в капле размножается бактерия, производящая флуоресцентный белок, то она будет светиться под лазером зелёным светом, а вслед и вся капля спустя некоторое время будет светиться зелёным. Если же рост этих бактерий подавляется токсичной бактерией-соседкой, тогда зелёного свечения у капли не будет. Это самый простой случай, на деле, как правило, используется несколько красителей, и информации о жизни внутри капли получается больше.
Метод помогает создавать огромное количество таких капель и с очень большой скоростью их исследовать, пропуская поток эмульсии через специальное устройство — микрофлюидный чип. В нём капли выстраиваются друг за дружкой, поэтому можно не просто просветить лазером каждую каплю в отдельности, но даже отсортировать капли в зависимости от того, что мы в них увидим, и подвергнуть их дальнейшему анализу — изучить их геном и т. д. Например, отобрать капли, в которых один вид бактерий подавил рост других. За одну секунду можно проанализировать до 30 000 отдельных капель. Легко посчитать, что на скрининг миллиона капель потребуется чуть больше половины минуты, а для миллиарда капель — порядка 10 часов. С помощью такой технологии можно не только изучать, как бактерии подавляют друг друга, используя антибиотики, но и оценивать воздействие лекарственных препаратов на бактериальные сообщества или использовать скрининг для направленной эволюции ферментов.
В ходе работы исследователями была разработана система для высокопроизводительного поиска новых антибиотиков с одновременным определением механизма их действия, получившая название pDualrep2. Антибиотики могут как убивать бактериальные клетки, например, разрушая клеточные стенки, так и тормозить их рост и размножение, облегчая организму борьбу с инфекцией силами собственного иммунитета. Мешать бактериальной клетке жить и плодиться можно разными способами, но примерно половина известных антибиотиков делают это, вставляя палки в колёса одной из важнейших молекулярных машин клетки — рибосоме. В рибосоме происходит синтез необходимых клетке белков, соответственно, если антибиотиком «испортить» рибосому, то и вся бактерия на некоторое время выйдет из строя. С помощью биохимической системы pDualrep2 можно в высокопроизводительном режиме определить, какое из тестируемых веществ действует как антибиотик, и работает ли оно по принципу «остановки» рибосомы. В ходе исследований были найдены несколько новых ингибиторов синтеза белка. Например, клебсазолицин — новый пептидный антибиотик, вырабатываемый штаммом бактерии Klebsiella, закупоривает туннель, через который пептид покидает рибосому.
