Есть контакт! От клеточной адгезии к нетоксичной терапии рака
…Ввиду краткости нашей жизни мы не можем позволить себе роскошь заниматься вопросами, не обещающими новых результатов. Л. Д. Ландау
Любая противораковая терапия чревата побочными эффектами, потому что под удар попадают не только раковые клетки, но и вполне здоровые. Побочные эффекты порой оказываются столь тяжелы, что практически сводят на нет противораковый успех. Львиная доля исследовательских усилий в этой области посвящена поиску нетоксичной терапии, которая была бы безвредной в отношении организма, его тканей и органов. Но, конечно, в отношении опухолевых клеток такая терапия должна оставаться очень токсичной и очень агрессивной.
Наш собственный иммунитет, если можно так сказать, практикует нетоксичную терапию. Патологические клетки, злокачественные или инфицированные, должны быть уничтожены. Одни из главных исполнителей здесь — специальные лимфоциты, называемые цитотоксическими. Цитотоксический лимфоцит вводит в патологическую клетку свои агрессивные соединения (интерфероны, ферменты, оксид азота NO, дофамин и т. п.), которые запускают программу клеточного самоуничтожения (апоптоз), и в итоге клетка аккуратно разрушается. Важно, что токсические вещества вводятся из лимфоцита непосредственно в больную клетку. Лимфоциты не выливают своё лекарство абы где в надежде, что оно рано или поздно доберётся до цели, — их агрессивные соединения не проходят системно по всему организму, как это бывает, например, при лечении химиопрепаратами. Действия лимфоцитов безвредны для организма, будучи агрессивными только в отношении аномальных клеток. Залог этого — непосредственный контакт между лимфоцитом и целевой клеткой, который обеспечивается сложным адгезионным аппаратом.
Адгезия между клетками при опухолевом росте
Около 50 лет назад группа учёных из Института экспериментальной онкологии в составе тогдашнего Всесоюзного онкологического научного центра Академии медицинских наук СССР (впоследствии переименованного в Национальный медицинский исследовательский центр онкологии им. Н. Н. Блохина) начала изучать адгезионные взаимодействия между клетками — в нормальной ткани, в опухолевой, а также в ткани, предрасположенной к опухолеобразованию. Клеточную адгезию нередко упрощают до прилипания или слипания клеток с субстратом или друг с другом. Однако это «прилипание» означает не просто механическую фиксацию, но и обмен специфическими сигналами, влияющими на состояние клеток. Ключевую роль в адгезии играют белки контактины-кадхерины. Было выявлено, что они повышают устойчивость ткани к злокачественному новообразованию, иными словами, подавляют рост опухолей. Сила сцепления между клетками (взаимная адгезивность) в ткани, обусловленная, вероятно, содержанием контактина в области межклеточного соединения, влияла на устойчивость ткани к опухолеобразованию*. Число высокоадгезивных участков в устойчивой ткани печени мышей оказалось в три раза больше, чем у мышей, предрасположенных к печёночным опухолям, что видно по электронной микроскопии.
* Маленков А. Г., Бочарова О. А., Модянова Е. А. Явление увеличения сил сцепления при межклеточном взаимодействии в эпителиальных тканях в раннем постнатальном периоде. Диплом на открытие № 330. Сборник кратких описаний открытий, внесённых в Государственный реестр открытий СССР // ГК по изобретениям и открытиям при ГКНТ СССР. М., ВНИИПИ, 1988, с. 30—31.
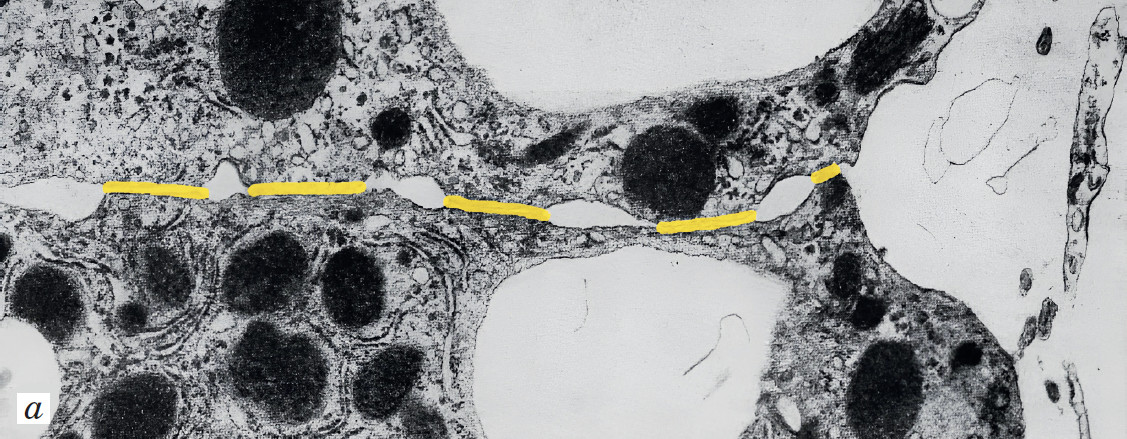

Адгезия помогает клеткам оставаться в зрелом, дифференцированном состоянии. С помощью правильных адгезионных контактов клетки, так сказать, постоянно напоминают друг другу, чем они должны заниматься. Если контакт нарушен, клетка забывает про свои функции и пускается в пляс беспробудного размножения, то есть становится «асоциальной», опухолевой. На следующем этапе она теряет контактные молекулы, которые отвечают за взаимодействие с иммунитетом. Из-за этого цитотоксические лимфоциты, о которых говорилось выше, не могут состыковаться со злокачественными клетками**.
** Подробно об адгезионной динамике при злокачественном перерождении клеток рассказывается в статье: Бочарова О., Кучеряну В. Потеря контакта. Адгезия в биологии рака. «Наука и жизнь» № 2, 2023 г.
Контактные взаимодействия цитотоксического лимфоцита и опухолевой клетки

Адгезионный аппарат существует не сам по себе. На него влияют биохимические, клеточные, физиологические процессы, которые, на сторонний взгляд, не должны иметь никакого отношения к межклеточному сцеплению. Например, дофамин «в миру» известен преимущественно как нейромедиатор, который используется в мозговых центрах, отвечающих за эмоциональную, мотивационную и двигательную сферы. Но кроме этого центрального дофамина есть дофамин периферический, основные запасы которого содержатся в тромбоцитах и лимфоцитах. Дофамин лимфоцитов способствует их миграции в опухоль и помогает им войти в контакт с опухолевыми клетками. А для самих опухолевых клеток дофамин является своего рода токсином, который подавляет их деление и развитие питающих их сосудов. Иными словами, дофамин играет довольно важную роль в иммуноадгезионных механизмах, обеспечивающих целенаправленную борьбу иммунных клеток с патологическими. При этом периферический дофамин зависит от центрального.
В связи с дофаминовыми механизмами мы неизбежно приходим к проблемам хронического стресса и старения, которые, среди прочего, бьют по дофаминергическим нейронам мозга. Потеря дофаминергических нейронов в мозге сказывается на периферическом дофамине со всеми вытекающими последствиями для клеточной адгезии***. Известно, что вероятность очень многих онкозаболеваний повышается с возрастом, то же самое говорят про хронический стресс. Значимую роль здесь играют возрастные и стрессовые адгезионные аномалии, возникающие в том числе из-за проблем с дофамином. Если мы поможем клеткам поддерживать в порядке их адгезионные механизмы, то, во-первых, сама ткань начнёт лучше сопротивляться появлению опухолей, во-вторых, иммунная система будет эффективнее истреблять опасные клетки, если они всё-таки появятся. Однако в поиске таких адгезиостимулирующих и адгезиокорректирующих инструментов нужно учитывать большой комплекс явлений, связанных с нервной системой и иммунитетом, со старением и стрессом.
*** См. статью: Бочарова О., Кучеряну В. Дофамин, старение, стресс и рак. «Наука и жизнь» № 2, 2021 г.
