«Медицина стала точной наукой»
Профессор РАН Антон Буздин — о революции в изучении человека и новых подходах к терапии рака

ScholarGPS. В течение последних пяти лет он имеет высокие позиции по направлению
секвенирования РНК, в области генной экспрессии и по тематике биомаркеров. Олег Сердечников
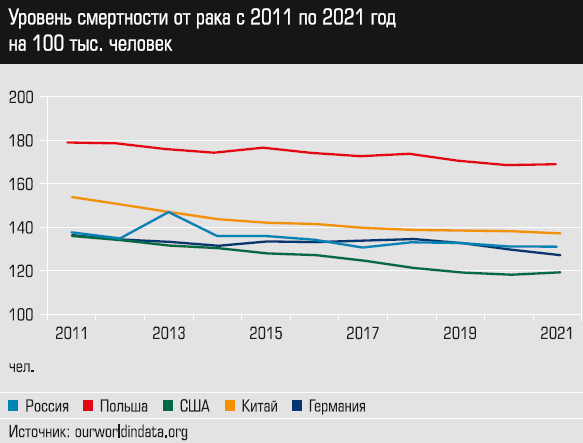
Развитие генетики и биоинформатики позволило совершить прорыв в онкологии — получить максимум данных о конкретных опухолях, увидеть происходящие в них процессы на молекулярном уровне. Это дает возможности фармкомпаниям усилить разработку таргетных противораковых лекарств, а клиницистам — подбирать оптимальную линию терапии для пациентов.
О перспективных направлениях в области онкомедицины мы поговорили с главным научным сотрудником Института персонализированной онкологии Сеченовского университета, профессором РАН Антоном Буздиным. По итогам 2024 года международная аналитическая платформа ScholarGPS включила его в Top Scholars, то есть в 0,5% самых влиятельных ученых планеты. Профессор известен в науке исследованиями в области эволюции генов и молекулярных путей, а также разработкой платформы «Онкобокс», которая использует РНК-секвенирование для подбора таргетных препаратов, и платформы «Онкофьюжн» для выявления онкогенных перестроек генов.
— Антон Александрович, какие изменения в медицине вы бы выделили из общего ряда достижений за последние десять-двадцать лет?
— Сейчас мы живем в удивительные времена, когда происходит впечатляющий переход медицины от искусства времен Парацельса к точной науке. Науки о живом всегда выделяли в отдельную ветвь — есть точные науки, а есть естественные науки, несущие в себе какие-то элементы точных. И вот в нашей области сейчас этих элементов стало уже больше, чем всего остального. Это удивительное следствие развития такой современной технологии, как секвенирование. Секвенирование — это определение последовательности ДНК. Причем это касается даже не только медицины, но и других естественных наук и даже гуманитарных. Например, благодаря секвенированию история тоже становится точной наукой. Казалось бы, есть работа с источниками, но источники всегда тенденциозны, поскольку написаны людьми со своей собственной позицией, а иногда источников вообще нет. Но сейчас мы можем из остатков биологического материала получить огромный массив информации. Можем понять, кто были эти люди генетически, определить, что они ели, где родились, как мигрировали, чем болели и так далее. Все это сейчас можно определить точными научными методами. Фантастика. Вот так вот технологическая революция в аналитических методах молекулярной биологии фактически и сделала биологию и медицину точными науками.
— Вы не преувеличиваете насчет революции?
— Именно революция, которая состоит еще из множества прорывных элементов. Если мы говорим про медицину, про лечение больных, то вот таким большим прорывом стала иммунотерапия, которая позволяет активировать собственную иммунную систему больного так, что она перестает злокачественную опухоль не замечать и начинает ее активно атаковать. Сейчас появляется целый ряд новых подходов. И хотя они еще не сделали практической революции в лечении, скорее носят вспомогательную роль, но роль иммунотерапии в лечении пациентов постоянно растет.
Еще одна революция — в анализе данных. Появление огромных массивов данных, в том числе находящихся в открытом доступе, позволяет ученым уже не делать свои эксперименты, а просто брать данные, обсчитывать чужие результаты и грамотно их интерпретировать, получая отличные научные результаты.
— В свете развития этих революционных методик какие основные задачи решаются в области онкологии?
— Мне кажется, что важнейшая задача на сегодня — создание максимально полной молекулярной модели каждой конкретной опухоли. В идеале она должна учитывать все то многообразие опухолевых клонов, которые существуют. По-научному это называется «многослойный перцептрон». Это некая модель молекулярных взаимодействий, на которую спроецированы конкретные особенности патологических клеток. Создание такой модели поможет эффективно моделировать терапевтические подходы. Причем не только их, но и те вероятные механизмы, которыми опухоль будет пытаться избегнуть терапии, то есть выработать резистентность, а нам это позволит разработать уже следующий шаг для терапии.
Проще говоря, мы даем первый набор терапии, опухоль делает свой ход, а у нас уже наготове следующий. Или, например, предсказываем, с помощью каких конкретно механизмов опухоль будет пытаться избегнуть действия препаратов. И мы можем подобрать терапию так, чтобы заблокировать опухоли эту возможность. А раз мы ее заблокируем, то сможем с большей эффективностью ее убить. Такого рода модели будут крайне полезны как для онкологии, так и для всех других отраслей биологической и медицинской науки.
— И насколько мы далеки от прорыва?
— В принципе, у нас есть технические возможности для этого. Я сейчас получил мегагрант в «Сириусе» как раз под такую задачу. Конечно, я не кладу голову на рельсы, что через три года мы эту проблему точно решим, но я уверен, что мы приблизимся к решению, а дальше будем улучшать качество этих моделей. Потому что они должны, с одной стороны, учитывать много факторов, но с другой стороны, все эти факторы имеют разный вес. Какие-то значат много, какие-то - меньше. Причем они еще имеют этот вес в определенном контексте. То есть фактически речь идет о создании цифровых двойников опухоли.
— Следующий шаг — персонализация терапии рака?
— Да, использование современных методов биоинформатики для создания новых лекарств и их персонализации. С помощью этой цифровой модели мы сможем создавать более специфичные таргетные препараты, которые более точно связываются со своими конкретными молекулярными мишенями.
Еще один шаг — таргетный препарат следующего поколения, который связывается не просто с какими-то конкретными белками, которые в принципе есть и в здоровых клетках. Они связываются только с мутированными белками, которые есть только в раковых клетках. То есть эти препараты будут еще более точно действовать на опухоль и наносить существенно меньше вреда здоровым клеткам, потому что у них меньше ошибочная активность. Собственно, их без всякого искусственного интеллекта открыли с помощью массового скрининга. Но искусственный интеллект может на несколько порядков снизить размерность такого скрининга.
— Какие способы лечения онкозаболеваний сегодня рассматриваются в науке как наиболее перспективные?
— У нас очень много разных способов лечения опухолей. Все они так или иначе как-то себя проявили, и мы уже можем персонализировать их назначение. Следующий шаг, этому нам еще предстоит научиться, — персонализировать назначение их в комбинации, потому что комбинация таргетных препаратов будет гораздо эффективнее, чем использование их по отдельности. Как происходит лечение сегодня? Есть рабочая терапевтическая схема, которая неплохо себя проявляет, и поверх нее добавляют еще препарат, который оказывает персонализированное воздействие. А идея заключается в том, чтобы добавлять не один препарат, а сразу несколько. Чтобы получалась комбинация, которая не просто затормозит рост опухоли, а убьет ее. Но при этом не убьет самого больного. То есть такая комбинация, которая синергечно складывает токсичности отдельных компонентов против опухоли, но останется относительно безобидной для здоровых тканей. Потому что именно такие комбинации действуют лучше всего.
ИИ допускает много ошибок
— На ИИ и Big Data возлагают большие надежды. Но по факту ведь еще ничего не случилось — не создано лекарство от рака, которое помогало бы на любой стадии болезни, нет волшебной таблетки от старости…
— Очень важно правильно интерпретировать имеющуюся информацию, потому что если ты неправильно сформируешь какие-то группы для сравнения, то получишь в корне неправильные результаты. Сейчас важна интерпретация и понимание того, как именно были получены эти данные, для чего они подходят. Если понимать это, то в руках человека, который занимается анализом данных, оказывается просто бесценный кладезь информации. Информации настолько много, что мы, ученые, можем распорядиться грамотно только двумя-тремя процентами.
— На сколько, по вашей оценке, ИИ может повысить КПД в науке?
— Искусственный интеллект наверняка тоже будет полезен, но пока мы только нащупываем способы, как он нам может помочь анализировать геномные данные.
Пока такие модели создаются, но они не лучше алгоритмических подходов обработки информации. ИИ допускает очень много ошибок, а проверка этих ошибок занимает гораздо больше времени, чем если сделать это алгоритмическими методами, которые работают по понятным нам законам. ИИ — это черный ящик. Мы не видим, что у него под капотом. Он выдает нам что-то. Часть ответа корректная, а часть — нет. Он часто галлюцинирует, выдает ответы, просто чтобы от него отстали, придумывает ссылки на несуществующую литературу. Если вам дороги результаты вашего исследования, то вы можете очень сильно отравить их вот такими ошибками.
