Временно спящие: как бактерии скрываются от антибиотиков
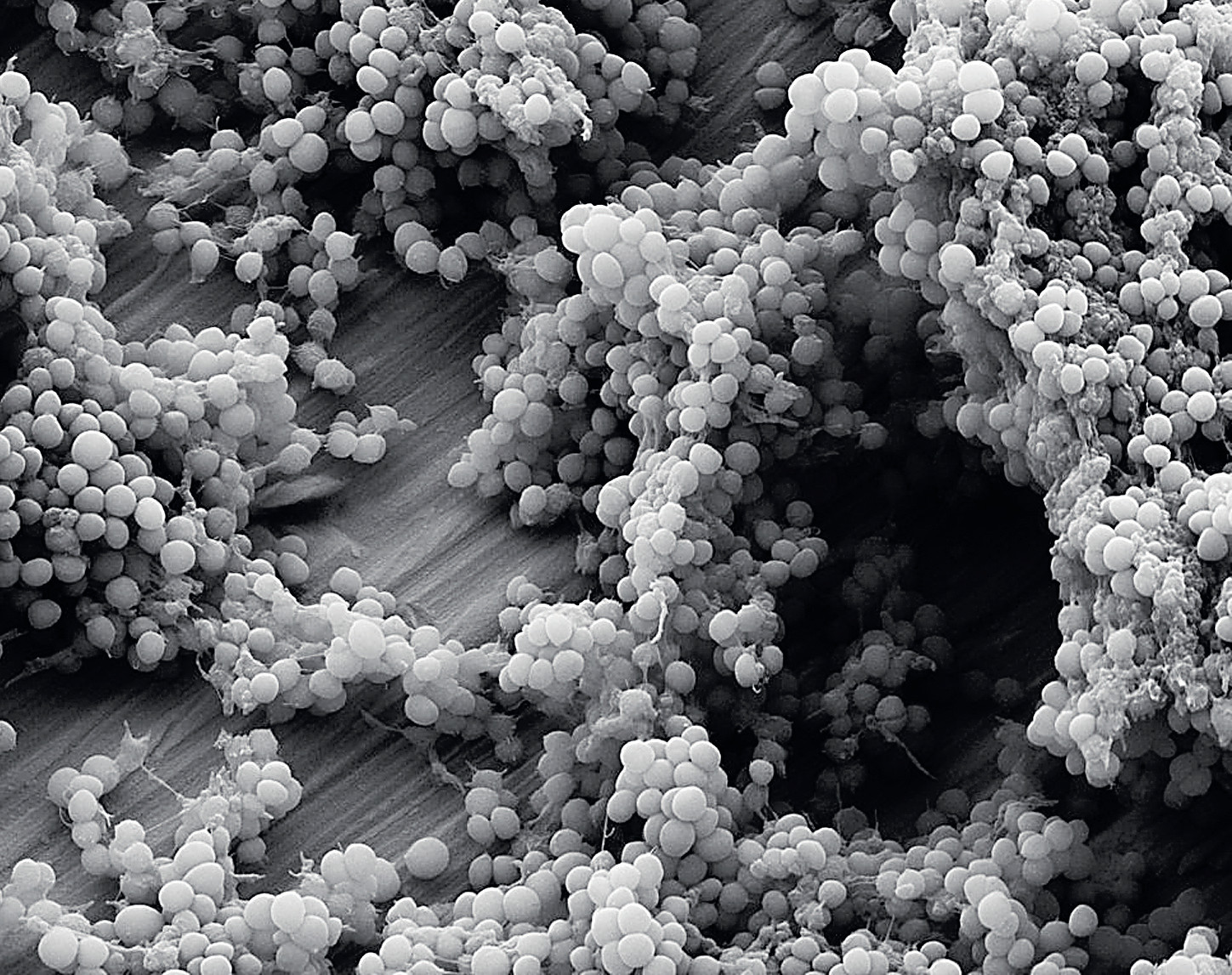
В последние десятилетия проблема устойчивости бактерий к антибиотикам стала очень острой. Однако на фоне пандемии коронавируса интерес к этой теме несколько упал, хотя ситуация с антибиотикорезистентностью лишь усложняется: бактерии, которые приобретают устойчивость к одному антибиотику, зачастую становятся резистентными и к другим антибиотикам того же класса.
Сейчас поиск новых классов антибактериальных препаратов сильно замедлился. В предыдущие 15 лет был введён в практику лишь один новый класс антибиотиков, и то против грамположительных бактерий, а новый класс антибиотиков широкого спектра действия последний раз был открыт ещё в 60-е годы прошлого века. Разработка новых антибактериальных препаратов стала попросту невыгодна, поскольку на их поиск тратится уйма времени и денег, тогда как потерять эффективность они могут всего за пару лет.
Но даже если удастся открыть «абсолютный» антибиотик, к которому не будет вырабатываться резистентность, бактерии всё равно периодически смогут избегать его действия, просто входя в метаболически неактивное состояние. Такое состояние называется персистенцией (от англ. «persistent» — устойчивый).
Вернуться к жизни
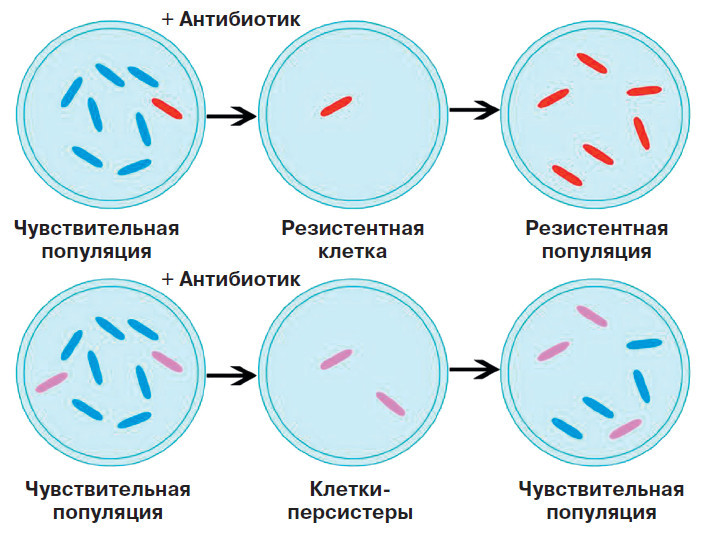
В 1942 году двое учёных — американский микробиолог Глэдис Хобби и ирландский врач Джозеф Биггер — независимо друг от друга заметили рост убитой пенициллином культуры Staphylococcus aureus после пересева на новую среду без антибиотика. То есть после обработки пенициллином бактериальные клетки разрушались, но после пересева на чистую среду культура, которая должна была погибнуть, вновь образовывала колонии благодаря небольшой популяции выживших, но не обладающих резистентностью клеток. Иными словами, некоторые клетки входили в такое состояние, в котором пенициллин их не убивал, а затем выходили из него и размножались. Однако после новой обработки пенициллином образовавшаяся культура опять погибала.
Феномен персистенции имеет совершенно другие механизмы, нежели устойчивость бактерий к антимикробным препаратам. Персистенция — это неспецифический механизм, то есть способ защиты от большого количества разнообразных повреждающих факторов. Она может активироваться спонтанно или в ответ на различные стрессовые факторы окружающей среды.
Резистентность же вырабатывается против конкретного антибиотика. Возникает она благодаря случайным мутациям бактериальной клетки, приводящим к модификации мишени антибиотика, инактивации самого антибиотика или более активному его выбросу из бактериальной клетки. Резистентность передаётся по наследству: все потомки такой бактерии смогут жить и размножаться в присутствии антибиотика.
Персистенция — это что-то вроде спящего состояния бактерий. Клетка живёт, но остаётся неактивной, ничего не потребляет и не выделяет, а значит, лишена активных мишеней для действия антибиотиков. Но как только бактерия выходит из такого состояния и начинает делиться, антибиотик вновь способен её уничтожить.
Персистенция свойственна абсолютно всем протестированным на данный момент бактериям, и при благоприятных условиях многие культуры имеют небольшую (1—3%) долю персистеров, биологический смысл которых — сохранение популяции в случае изменения условий окружающей среды. Какие гены участвуют в персистенции, определить бывает трудно. Дело в том, что очень много генов «ответственны» одновременно не только за персистенцию, но и за множество других функций, и эти гены нельзя просто удалить и посмотреть, сохранится ли способность клетки персистировать, так как в ней будут нарушены и другие процессы.
Механизмов перехода обычной клетки в метаболически неактивное состояние много, они избыточны и могут дублировать друг друга, что подтверждает важность персистенции в жизни бактерий. На данный момент основным способом входа в персистентное состояние считается активация системы токсин-антитоксин (ТА-система). Токсинами в этом случае выступают стабильные молекулы, которые нарушают такие важные функции клетки, как транскрипция (считывание информации с ДНК) и трансляция (синтез белка). Бактерии синтезируют такие токсины внутри себя для саморегуляции, но обычно их нейтрализует антитоксин, образующий с токсином неактивный (то есть не способный вступать ни в какие биохимические реакции) комплекс. Поскольку токсины задерживают клеточный рост и таким образом снижают активность мишеней для антибиотиков, они вносят свой вклад в образование персистеров. Получается, что бактерии могут образовывать меньше антитоксина, в результате чего токсин будет замедлять метаболизм и вводить клетку в неактивное состояние.
Как же исследовать персистенцию, если в её образовании могут принимать участие огромное количество разных токсинов? Для начала исследователи попытались выделить бактерии, образующие персистентные клетки чаще, нежели обычная популяция. Это привело к получению hip-мутанта E. coli (hip — сокр. от англ. high persistence) hipA7, который проявлял в 100—1000 раз большую частоту образования персистеров, чем родительский штамм. Впервые этот мутант получили Харрис Мойед и Кевин Бертран из Калифорнийского университета, о чём в 1983 году у них вышла статья в «Journal of Bacteriology». У обычных бактерий ген hipA кодирует токсин, а hipB — антитоксин. Но у hip-мутантов ген hipA мутировал, и продукт больше не обезвреживается антитоксином, что способствует образованию персистентных клеток.
Подобных мутантов стали искать в биологическом материале больных хроническими инфекциями и выделять из клинических изолятов (то есть из чистой культуры) бактерий Pseudomonas aeruginosa. Впоследствии в лабораториях стали получать других мутантов, которые тоже часто образуют персистеры, однако неизвестно, встречаются ли подобные лабораторные мутанты в клинике и не являются ли такие искусственные механизмы повышенного образования персистеров артефактами, и на самом деле в природе не встречающимися.
