Треугольник Менделеева: снова об элементарных периодах
2019 год объявлен годом 150-летнего юбилея открытия периодического закона и создания системы элементов Д. И. Менделеева. Говоря об элементах, слово «система» часто заменяют на «таблица». Справедливо ли это? Стоит попробовать на основе детального анализа исходного и нескольких последующих вариантов её отображения обосновать вариант, который бы отвечал современным представлениям о структуре материи и был бы удобен для восприятия и использования в качестве учебного пособия в средней и высшей школе. Конечно, затрагиваемые в статье особенности нейтронных звёзд и позитронного вещества — пока ещё не предмет приложения практической космонавтики, но предлагаемый подход будет полезен для определения природы химических связей в природе, перспектив создания новых материалов, а также формирования программ космических экспериментов в различных направлениях астрофизики и геофизики.
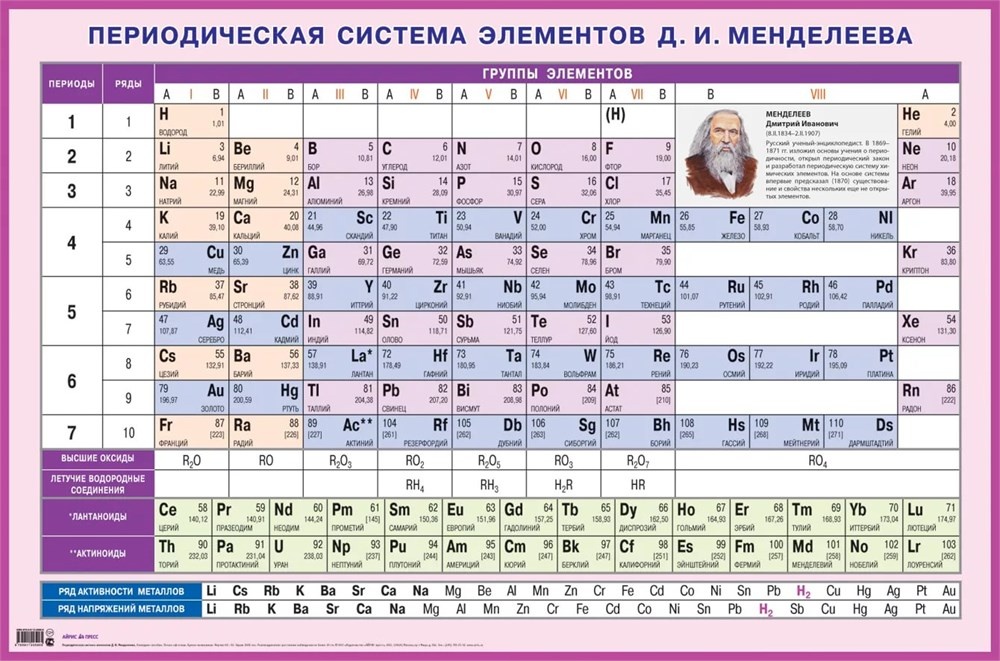
Таблица элементов – одно из изображений, памятных всем со школьного детства. Да и куда ещё посмотришь, когда в окно – не разрешают! Расположение элементов на первый взгляд выглядит просто.
Действительно, отложив вдоль одной из осей значения валентности как основы химического сходства, благодаря закону периодического повторения свойств удаётся построчно разместить последовательность элементов, упорядоченную по атомному номеру (равному значению заряда ядра атома), сформировав тем самым вдоль другой оси группы похожих элементов.
Короткоживущие правила короткой таблицы
Но внимательное размышление над всё ещё наиболее распространённым коротким вариантом изображения таблицы даёт удивительный результат: простота и наглядность свойственны только двум строчкам: второй и третьей, число элементов в которых равно количеству значений валентности – восемь.
Первую строку от последующих сразу отличают шесть пустых клеток между водородом и гелием. К тому же в одной из них символ водорода попадается во второй раз. Правда, в скобках.
А начиная с четвертого периода строки раздваиваются, и порядок нарушается. В предпоследнем широком столбце пустые клетки чередуются с трёхместными. А в других клетках строк с трёхместными свойства элементов не вполне укладываются в группы. Это выражено введением подгрупп валентности А / В и, соответственно, смещением символов элементов то к левому, то – к правому краям клетки.
В шестом-седьмом периодах плюс ко всему – ссылки на двухэтажный подвал лантаноидов и актиноидов, не вместившихся в таблицу.
Наконец, недоумение вызывает и явная ограниченность таблицы известным сегодня набором элементов. Что дальше? Хотя за прошедшие со времён провозглашения периодического закона полтора столетия было открыто новых элементов едва ли не больше, чем было известно до этого, этот короткий вариант отображения таблицы являет собой завершённое произведение – вписывать вновь открытые после оганесона элементы уже некуда!
Итак, простые, казалось бы, правила сохраняются исключительно в пределах двух периодов, потом – весьма существенные изменения. И это на множестве всего-то семи периодов и восьми групп! Такую изменчивость правил не назовёшь простой и наглядной. А ведь эти качества очень важны и для учебного пособия, а главное – для мировоззрения.

Помехи и успехи исходной системы
Примечательно, что указанные сложности привнесены в систему позже из-за главного внимания к валентности элементов. А в опубликованной 150 лет назад исходной рукописи великого русского химика «Опыт системы элементов, основанной на их атомном весе и химическом сходстве» их нет.
Удивительно, как удалось Дмитрию Ивановичу разглядеть периодичность системы при весьма существенных помехах. Во-первых, элементов к тому времени знали почти вполовину меньше, чем сейчас. Нейтральные газы и вовсе отсутствовали, а это – целая группа (и колонка в таблице)! Во-вторых, ещё не было знаний о заряде атомного ядра, по которому теперь нумерованы элементы системы. Значения же атомных масс, определяемые по соотношениям в химических реакциях, были не просто неточны, а порой ошибочны в несколько раз: вдвое, а то и втрое! И никакого представления об изотопах, легко объясняющего теперь, почему массы атомов немного отличны от величин, кратных массе атома водорода. А в-третьих, изменчива и сама основа химического сходства – валентность. Известно, что одни и те же элементы образуют вещества, выступая с разными значениями валентности. Окиси и закиси, например.
Перечисленные помехи привели к отдельным ошибкам – помещении некоторых элементов не в ту группу. Но это не помешало Д.И. Менделееву не только исправить отдельные неточности в определении атомных весов ряда известных элементов, но и указать ещё неоткрытые элементы. И три из им предсказанных – настоящие «национальные достояния»: галлий, германий и скандий!
