Клоны флуоресцирующей макаки помогли оценить безопасность точечного редактирования генома

Китайские исследователи применили метод редактирования оснований ABEmax для выключения флуоресцентного белка у клонов генно-модифицированного макака-резуса. Использовав собственный подход, они проанализировали количество возникших при этом нецелевых мутаций и пришли к выводу, что в ДНК их практически нет, но в матричной РНК — множество. Хотя эффект этого временный, его необходимо учитывать при внедрении технологии в клиническую практику. Результаты работы опубликованы в журнале ScienceAdvances.
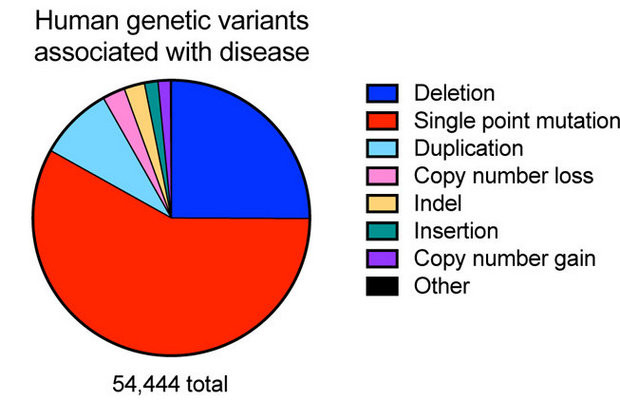
Генетический код человека записан в ДНК четырьмя «буквами» — азотистыми основаниями: пуриновыми аденином (А), гуанином (Г), пиримидиновыми тимином (Т) и цитозином (Ц), которые спарены в двух цепочках ДНК парами А–Т и Г–Ц по принципу комплементарности. Точечные мутации, затрагивающие единственное азотистое основание, составляют более половины известных генетических вариантов, связанных с заболеваниями.
Holly A. Rees and David R. Liu / Nature Reviews Genetics, 2018
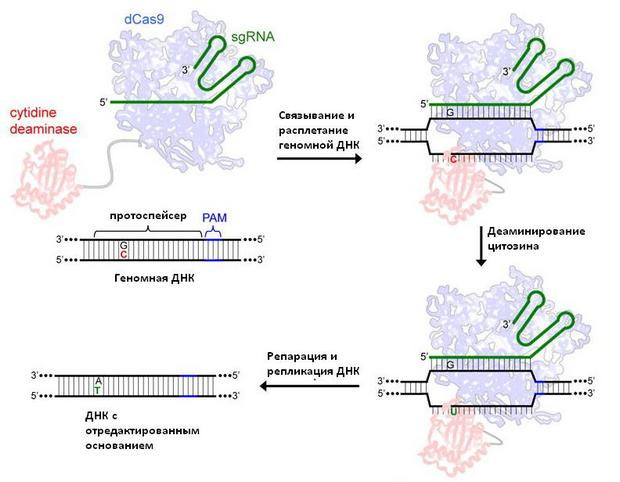
Для их коррекции в 2016 году на основе CRISPR/Cas9 (которая плохо подходит для этих целей из-за большого числа ошибок — инсерций и делеций) была разработана технология редактирования оснований (base editing). Она также прицельно ищет заданный участок генома с помощью направляющей РНК, но, в отличие от материнской методики, разрезает не обе цепочки ДНК, а одну (для этого используется никазный вариант Cas9 или Cas13), подавая сигнал клеточным механизмам восстановления ДНК. На соответствующем участке нетронутой цепочки фермент деаминаза превращает аденин в инозин (adenine base editor, ABE) или цитозин в урацил (cytosine base editor, CBE), которые при репарации комплементарны цитозину или аденину соответственно. В итоге после репликации ДНК пара А–Т заменяется на Г–Ц (в случае ABE) или Ц–Г — на Т–А (в случае CBE), и искомая точечная мутация устраняется.